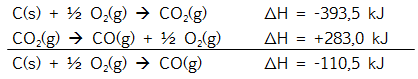insyaallah selalu bermanfaat, karna dalam setiap usaha N pengorbanan yang dilakukan tidak ada yang sia-sia.. Nailis/4301411140/magnesiumPGMIPABI
Selasa, 28 Oktober 2014
Senin, 06 Oktober 2014
TERMOKIMIA
Setiap benda di alam semesta memiliki
energi. Apa yang dimaksud dengan energi? Secara sederhana, energi didefinisikan
sebagai kemampuan untuk melakukan kerja. Tuhan yang Mahabesar menciptakan
matahari sebagai sumber energi terpenting dan terbesar bagi kehidupan. Maka
dari itu kita sebagai mahluk ciptaan Tuhan wajib bersyukur atas kebesaranNya.
Jika sebatang kayu dibakar, energi kimia
yang dimiliki kayu akan diubah menjadi energi kalor. Berapakah jumlah energi kalor
yang dihasilkan dari pembakaran kayu tersebut?
Jumlah total energi kalor yang terkandung
dalam suatu materi disebut entalpi dan diberi simbol H, berasal dari kata heat
yang didefinisikan sebagai kalor. Entalpi suatu zat tidak berubah selama tidak
ada energi yang masuk atau keluar.
Entapli suatu zat tidak dapat diukur,
tetapi perubahan entalpinya dapat diukur. Perubahan entalpii terjadi ketika
suatu zat mengalami reaksi yang kemudian diberi notasi ᐃH. Nilai dari ᐃH
menyatakan kalor yang diterima atau yang dilepas oleh suatu reaksi. Dengan kata
lain, ᐃH merupakan penambahan atau pengurangan energi suatu zat dalam suatu
proses perubahan energi yang berlangsung pada tekanan tetap.
REAKSI EKSOTERM DAN ENDOTERM
Sudah mendapat penjelasan dikelas kan? Cobalah untuk mengerjakan soal yang ada dibawah ini dengan memperhatikan contohnya.
Sudah mendapat penjelasan dikelas kan? Cobalah untuk mengerjakan soal yang ada dibawah ini dengan memperhatikan contohnya.
Contoh
soal:
Tentukan
apakah reaksi-reaksi berikut endoterm atau eksorterm.
a.
AgBr(s)
à Ag(s) + 1/2Br2(l) ᐃH = +99,96 kJ
b.
H2(g) + 1/2O2(g)
à H2O(s) ᐃH
= -292 kJ
Jawab:
a.
Penguraian AgBr menjadi Ag dan Br2
merupakan reaksi endotermn karena ᐃH-nya positif (menyerap kalor)
b.
Pembentukan H2O merpakan reaksi
eksoterm karena ᐃH-nya negatif (melepaskan kalor)
JENIS-JENIS ENTALPI REAKSI (ᐃH)
How about this section? Try to find the explanation of each point by yourself and you should read your book first.
Apa pentingnya tanda pada harga ᐃHfº?
Suatu
senyawa memiliki harga ᐃHfº
positif jika terbentuk dari unsur-unsurnya melalui reaksi endotermik. Reaksi kebalikannya,
yaitu pengubahan senyawa tersebut menjadi unsur-unsurnya adalah reaksi
eksotermik. Dikatakan bahwa unsur-unsur senyawa tersebut tidak dapat dibuat,
tetapi hanya menunjukkan kecenderungan senyawa tersebut untuk bereaksi
menghasilkan produk dengan entalpi pembentukan yang lebih rendah.
Jika
tidak ada kriteria lain yang tersedia, kimiawan kadang-kadang menggunakan
perubahan entalpi sebagai indikator kasar dari kemungkinan reaksi kimia yang
terjadi. Reaksi eksotermik umumnya lebih mungkin terjadi secara spontan
daripada reaksi endotermik.
1.
Jika jumlah mol dalam persamaan reaksi dikalikan
dengan bilangan x, perubahan entalpi untuk reaksi tersebut juga dikalikan x.
Contoh:
H2(g) + 1/2O2(g) à
H2O(s) ᐃH = -286 kJ/mol
2H2(g) + O2(g) à 2H2O(s) ᐃH
= (2)(-286) kJ/mol = -572 kJ
2. Jika
persamaan reaksi dibalik, perubahan entapinya diberi tanda berlawanan dengan
persamaan reaksi sebelumnya.
Contoh:
H2(g) + 1/2O2(g) à
H2O(s) ᐃH = -286 kJ
H2O(s) à H2(g) + 1/2O2(g) ᐃH = +286 kJ
H2O(s) à H2(g) + 1/2O2(g) ᐃH = +286 kJ
3. Menurut
perjanjian, perubahan entalpi pembentukan (ᐃHfº) suatu unsur bebas pada
keadaan standar = 0
Contoh: ᐃHfº Na(s), Fe(s), CL2(g), O2(g), H2(g) = 0
4.
Suatu kalor dapat digunakan joule (J),
kilojoule (kJ), kalori (kal), atau kilokalori (kkal) sebagai satuannya. 1
kalori = 4,18 joule.
Latihan
soal:
- Tuliskan
persamaan termokimia untuk reaksi-reaksi berikut ini.
a.
Pada reaksi C3H8(g)
+ 5 O2(g) à
3 CO2(g) + 2 H2O(l) dibebaskan kalor 223 kJ
b.
Pada reaksi CH4(g) + 2 O2(g)
à CO2(g)
+ 2 H2O(l) dibebaskan kalor 2.671 kJ
- Tuliskan
persamaan termokimianya jika diketahui data berikut.
a.
Pembentukan 13 gram gas C2H2
memerlukan kalor sebanyak 113 kJ
b.
Penguraian 11,2 L gas HCl (pada STP)
memerlukan kalor 18,2 kJ
- Tuliskan
persamaan termokimia untuk data berikut.
a.
ᐃHfº
H2O(l) = - 187,8 kJ mol-1
b.
ᐃHfº H2S(g) =
- 20,2 kJ mol-1
c.
ᐃHfº CaCO3(s) =
- 207,8 kJ mol-1
d.
ᐃHfº H2SO4(l)
= - 843,99 kJ mol-1
e.
ᐃHfº CH3Cl(s) =
+ 74,81 kJ mol-1
- PENENTUAN PERUBAHAN ENTALPI1. Secara LangsungPenentuan perubahan entalpi dapat dilakukan secara langsung yaitu melalui eksperimen menggunakan kalorimeter sederhana dengan tekanan tetap atau menggunakan kalorimeter bom. Kalorimeter adalah suatu alat untuk mengukur jumlah kalor yang diserap atau dibebaskan sistem. Data H reaksi yang terdapat pada tabel-tabel pada umumnya ditentukan secara kalorimetri. Jumlah kalor yang dilepas atau diserap sebanding dengan massa, kalor jenis zat, dan perubahan suhu. Hubungannya adalah sebagai berikut:q = m . c . ᐃTatauq = C . ᐃTdimana,q = kalor yang dibebaskan atau yang diserapm = massa zatc = kalor jenisC = kapasitas kalor kalorimeterᐃT = perubahan temperaturPada tekanan tetap terjadi perpindahan kalor antara sistem dan lingkungan sehingga kalor reaksi dapat dirumuskan sebagai berikut:qreaksi = - (qsistem + qkalorimeter)Jika dengan mengasumsikan tidak ada kalor yang hilang ke lingkungan, dan dengan mengabaikan kapasitas kalor kalorimeter, didapatqreaksi = - qsistemKalormeter tekanan-konstan yang terbuat dari dua cangkir kopi Styrofoam. Cangkir luar membantu menyekat campuran reaksi dari lingkungan. Dua macam larutan yang diketahui volumenya yang mengandung reaktan pada temperatur yang sama dicampurkan secara hati-hati dalam kalorimeter. Kalor yang diserap atau dihasilkan oleh reaksi dapat ditentukan dengan mengukur perubahan temperaturnya.
Untuk reaksi-reaksi yang melibatkan gas, pengukuran kalor reaksi dapat dilakukan dengan menggunakan kalorimeter bom. Kalorimeter ini dirancang sedemikian rupa sehingga seluruh energi reaksi akan berupa energi kalor.qreaksi = - qkalorimeter (dengan qkalorimeter = qbom+qair ...)Kalorimeter bom volume-konstan. Kalorimeter diisi dengan gas oksigen sebelum ditempatkan dalam tabung. Sampel dihubungkan ke listrik, dan kalor yang dihasilkan oleh reaksi dapat ditentukan secara tepat dengan mengukur kenaikan temperatur air di sekitarnya yang jumlahnya diketahui.Contoh soal 1Sejumlah 1,00 x 102 mL HCl 0,5 M dicampur dengan 1,00 x 102 mL NaOH 0,5 M dalam kalorimeter tekanan konstan. Temperatur awal larutan HCl dan NaOH adalah sama, yaitu 22,50ºC dan temperatur larutan campuran 25,86ºC. Hitunglah perubahan kalor untuk reaksi penetralan tersebut! Asumsikan kerapatan & kalor jenis larutan sama seperti air (masing-masing 1,00 g/mL dan 4,184 J/gºC)Penyelesaian:Dengan mengasumsikan tidak ada kalor yang hilang ke lingkungan dan dengan mengabaikan kapasitas kalor kalorimeter dapat ditulis:qreaksi = - qsistemdimana qsistem adalah kalor yang diserap oleh larutan campuran. Karena kerapatan larutan adalah 1,00 g/mL, massa 100 mL larutan adalah 100 g. Jadi,qsistem = (100 g + 100 g)(4,184 J/gºC)(25,86ºC-22,50ºC)qsistem = 2,81 x 103 Jqsistem = 2,81 kJdan qreaksi = - 2,81 kJdari molaritas yang diberikan, kita tahu bahwa terdapat 0,05 mol HCl dalam 1,00 x 102 mL larutan HCl dan 0,05 mol NaOH dalam 1,00 x 102 mL larutan NaOH. Jadi kalor penetralan ketika 1,00 mol HCl bereaksi dengan 1,00 mol NaOH adalahkalor penetralan = -2,81 kJ : 0,05 mol = -56,2 kJ/mol(karena reaksi berlangsung pada tekanan konstan, kalor yang dilepaskan sama dengan perubahan entalpinya.Contoh soal 2Pembakaran 1,01 g sukrosa (C12H22O11) dalam kalorimeter bom mengakibatkan temperatur naik dari 24,92ºC menjadi 28,33ºC. Kapasitas kalor pada rakitan kalorimeter adalah 4,90 kJ/ºC. Berapa kalor pembakaran sukrosa (dinyatakan dalam kilojoule per mol C12H22O11)?Penyelesaian:qkalorimeter = C . ᐃT = 4,90 kJ/ºC x (28,33ºC-24,92ºC) = 16,7 kJqreaksi = - qkalorimeter = - 16,7 kJini adalah kalor pembakaran dari 1,01 g sampel.Per gram C12H22O11 yaituqreaksi = - 16,7 kJ : 1,01 g C12H22O11 = -16,5 kJ/g C12H22O11Per mol C12H22O11qreaksi = (-16,5 kJ : g C12H22O11) x (342,3 g C12H22O11 : -5,65 x 10 3 kJ/mol C12H22O11)Latihan Soal1) Di dalam kalorimeter tembaga, 4 gram karbon dibakar sempurna menjadi CO2 pada tekanan tetap. Jika massa kalorimeter 1500 g dan massa air yang ada di dalam kalorimeter 2000 g, dengan temperatur mula-mula 25ºC dan temperatur akhir 35,93ºC. Kapasitas kalor tembaga (cCu) 0,4 J/gK dan kapasitas kalor air (cH2O) 4,2 J/gK. Berapa kJ per mol perubahan entalpi pembakaran 1 mol karbon?2) Amonium nitrat (NH4NO3) sebanyak 2 g dilarutkan dalam 40 g air dalam kalorimeter polistirena. Temperatur mengalami penurunan dari 23,1ºC menjadi 19,1ºC. Reaksi tersebut tergolong reaksi eksoterm datau endoterm? Berapa entalpi reaksinya?3) Entalpi pembentukan gas karbon dioksida pada 25ºC adalah -394 kJ/mol. Berapa gram karbon yang harus dibakar sempurna dalam kalorimeter tembaga yang massanya 1500 g dan massa air yang ada di dalam kalorimeter 2000 g agar terjadi kenaikan temperatur 7,29ºC. Kapasitas kalor tembaga 0,4 J/gK dan pada air 4,2 J/gK.
4) Pada pemanasan 400 g air dengan temperatur 25,65ºC diperlukan kalor 84,17 kJ. Jika diketahui kalor jenis air = 4,2 J/gºC, tentukan temperatur air setelah pemanasan!
1. Secara Tidak Langsung
Tidak semua reaksi dapat
ditentukan perubahan entalpinya secara langsung dengan kalorimeter, tetapi
dapat juga dicari secara tidak langsung. Sebagai contoh, entalpi pembakaran
tidak sempurna karbon membentuk karbon monoksida (CO) tidak dapat ditentukan
dengan kalorimeter.
C(g) + ½ O2(g) à
CO(g) ᐃH = . . . ?
Akan tetapi, entalpi
pembakaran karbon monoksida (CO) membentuk kabon dioksida (CO2) dan entalpi
pembakaran sempurna karbon (C) membentuk karbon dioksida (CO2) dapat ditentukan
dengan kalorimeter.
CO(g) + ½ O2(g) à
CO2(g) ᐃH = -283,0 kJ
C(s) + O2(g) à
CO2(g) ᐃH = -393,5 kJ
Untuk menentukan
perubahan entalpi yang terjadi pada pembentukan karbon monoksida, digunakan
hukum Hess yang berbunyi:
“Perubahan
entalpi (ᐃH) suatu reaksi tidak bergntung pada jalannya reaksi (banyaknya tahap
reaksi), tetapi hanya bergantung pada keadaan awal (pereaksi) dan keadaan akhir
(hasil reaksi) sistem.”
Reaksi pembakaran C dapat
diiustrasikan seperti pada gambar dibawah ini.
Menurut
hukum Hess: ᐃHf CO2
= ᐃHf CO + ᐃHc CO
Secara umum, perubahan
entalpi reaksi menurut hukum Hess diilustrasikan pada gambar dibawah ini
ᐃH reaksi (AàB)
= ᐃH
reaksi (AàCàDàEàB)
= ᐃH reaksi
(AàFàGàB)
Untuk menentukan ᐃH suatu reaksi secara tidak langsung, suatu reaski yang tahap-tahap
lainnya diketahui, dapat digunakan petunjuk berikut.
Langkah
1: Tulis persamaan reaksi yang yang ditanyakan
(misalnya pada reaksi pembentukan CO(g)).
C(s) + ½ O2(g) à
CO(g) ᐃH = . . . ?
Langkah
2: Zat-zat yang diketahui disesuaikan dengan
persamaan reaksi yang ditanyakan. Misalnya, pada contoh di atas C(s) dan O2(g)
ditulis disebelah kiri, sedangkan CO(g) ditulis di sebelah kanan. Persamaan
reaksi yang yang diketahui CO(g) ditulis secelah kiri. Oleh karena itu,
persamaan reaksi dibalik dan termasuk tanda ᐃH-nya.
Diketahui: C(s) + ½ O2(g)
à CO2(g) ᐃH =
-283,0 kJ
Dibalik: CO2(g) à
CO(g) + ½ O2(g) ᐃH = +283,0
kJ
Langkah
3: Dijumlahkan secara aljabar
Kamis, 16 Januari 2014
A Piece of Chemtool
Chemtool merupakan sebuah program yang digunakan untuk menggambar
molekul organik dengan mudah dan menyimpan gambar-gambarnya sebagai
bitmap X, Xfig, atau file EPS. Kebanyakan pengoperasian di chemtool
dapat menggunakan mouse.
Pada program chemtool menawarkan beberapa menu dasar seperti
undo/redo, dua font teks ditambah simbol, tujuh warna, menggambar
pada beberapa tingkat zoom, latar belakang gird persegi dan
heksagonal untuk mempermudahkan penggunaan align.
Berikut cara membuat struktur aspirin melalui chemtool. Sebelumnya buka dulu aplikasi Chemtool yang sudah di install hingga muncul tampilan seperti dibawah ini.
Kemudian pilih template di menu Tools hingga muncul tampilan seperti dibawah ini.
Setelah itu pilih cincin benzena dan lengkapi hingga membentuk struktur aspirin dengan menambahkan teks dan ikatan yang sesuai.
Semoga bermanfaat.. =D
untuk download software chemtool bisa langsung kunjungi
https://en.opensuse.org/Chemtool
https://en.opensuse.org/Chemtool
Rabu, 15 Januari 2014
Review Open Source Free Software
- BKchem
BKChem merupakan free software open source yang
digunakan untuk menggambar senyawa kimia. BKChem dikembangkan di GNU / Linux.
Namun itu berhasil digunakan di bawah WinXP dan MacOS X. Bagi yang mau mencoba
menggunakan program ini silahkan saja langsung ke alamat: http://bkchem.zirael.org/download_en.html
Untuk menggunakan program ini sangatlah mudah, silahkan ikuti petunjuk dasar dibawah ini.
Review Open Source Free Sotfware
- Jmol
Jmol merupakan sebuah software free open source yang digunakan
sebagai viewer struktur molekul. Program ini dapat dipakai oleh
pelajar, pendidik, dan peneliti dalam bidang kimia ataupun biokimia.
Program ini juga tersedia dalam berbagai platform, Windows, Mac OS X,
dan Linux/Unix. Apa yang dapat dilakukan oleh software tersebut
bagaimana menggunakannya dapat dipelajari pada situs resminya di
http://jmol.sourceforge.net/
Prewiew dan ilustrasi program Jmol yang dijalankan pada windows
adalah sebagai berikut:
Gambar 1. Tampilan Jmol ketika menampilkan senyawa alpha-caryophyllene
Gambar senyawa tersebut ditampilkan secara 3 dimensi. Tampilan gambar
3 dimensinya dapat diatur dalam berbagai posisi, seperti ilustrasi
berikut:
- MolWork
Program open source yang lain selain Jmol yang juga dapat
dioperasikan pada sistem Operasi Windows adalah MolWork. Program ini
sangat berguna untuk melakukan estimasi sifat-sifat suatu molekul
kimia dan juga dapat digunakan untuk visualisasi dan menggambar
molekul kimia. Molwork dibuat oleh Best System, Inc. dapat
dioperasikan pada sistem linux dan windows, namun sampai saat ini
hanya tersedia untuk windows XP/Vista/7. Program ini dibangun
menggunakan bahasa Java. untuk memperoleh software ini bisa langsung kunjungi alamat berikut: http://www.molworks.com/programs_en.html
Berikut ilustrasi program MolWork saat sedang digunakan untuk
estimasi sifat molekul caffeine.
- GDIS
GDIS
(Graphical
Display Interface for Structures)
adalah program visualisasi ilmiah untuk manipulasi, display, dan
analisis molekul terisolasi dan struktur periodik. Hal ini dalam
pengembangan, tapi tetap cukup fungsional. Ini memiliki fitur
berikut:
Dukungan
untuk banyak format file umum (CIF, PDB, XTL, XYZ, dan banyak lagi).- Job pengajuan alat untuk paket kimia komputasi: GAMESS, Gulp, ReaxMD, dan SIESTA.
- Job analisis dan alat grafik untuk simulasi dinamika.
- Berguna manipulasi alat, termasuk matriks transformasi dan konstruksi supercell.
- Permukaan yang kuat dan alat generasi kristal morfologi.
- Pola difraksi generasi dan merencanakan.
- Animasi multi-frame file.
- Aneka alat untuk visualisasi (pengukuran, pita, layar polyhedral).
Berikut
akan saya jelaskan beberapa langkah penggunaan aplikasi GDIS ini.
disini saya akan menggunakan contoh sederhana yakni dengan membuat
molekul air (H2O) dengan aplikasi ini. langkah-langkahnya adalah
sebagai berikut:
Seperti
biasa buka aplikasi GDIS, dimana tampilan awalnya akan seperti
berikut :
Klik pada ikon new model untuk membuat model baru,
Pada kolom model pilih model : editing,
Pada
bagian label ketik nama atom yang akan digunakan, kemudian klik pada
bagian Addatoms dan
klik pada jendela gambar, maka atom akan muncul. Pada penjelasan kali
ini saya akan membuat molekul air sehingga saya akan membuat dua atom
H dan sebuah atom O.
Berikutnya untuk membuat ikatan antar atom diatas, klik Add bonds dan klik salah satu atom dan tarik ke atom lainnya dan molekul air pun selesai kita buat…
Pada
aplikasi ini disediakan beberapa jenis tampilan molekul, seperti pada
aplikasi kimia lainnya dan untuk memilih tampilan yang diinginkan
dapat kita lihat dengan memilihDisplay pada
bagian model seperti pada gambar berikut ini.
Klik sesuai dengan keinginan maka secara otomatis bentuk molekul akan berubah-ubah sesuai pilihan anda.
Untuk mendapatkan programnya bisa langsung saja kunjungi: http://gdis.sourceforge.net/download.html
- Avogadro
Avogadro juga merupakan software editor molekul open source yang
biasa digunakan dalam kimia komputasi, pemodelan molekul, dan juga
bioinformatika. Program Avogadro yang tersedia dapat dijalankan pada
sistem Windows, Linux, dan Mac OS X yang bisa di download langsung
di: http://avogadro.openmolecules.net/wiki/Get_Avogadro
Bagaimana menggambar molekul sederhana menggunakan avogadro? Ikuti
saja langkah-langkah berikut.
Menggambar Molekul
Ketika Anda membuka Avogadro tanpa memuat default file menggunakan
Draw Tool. Tool ini adalah tool utama yang akan digunakan saat
menggambar molekul baru. Screenshot di bawah ini menunjukkan Avogadro
0.8.1 (tanpa terminal Python) pada KDE 4.1. Alat dock terletak di
atas tangan kiri dari interface dilambangkan dengan ikon pensil.
Kamu dapat memilih elemen yang ingin digunakan dengan mengklik menu
drop-down yang mengatakan 'Carbon (6)' pada screen shot. Elemen umum
dalam drop down, jika elemen yang ingin digunakan tidak dalam daftar
kemudian memilih 'Lainnya ...' akan memunculkan tabel periodik penuh.
Klik kiri sekali pada elemen akan memunculkan rincian lebih lanjut
dari unsur dalam kotak besar di tengah atas. Mengklik ganda sebuah
elemen akan memilih elemen dan menutup tabel periodik. Anda juga
dapat menyimpan tabel periodik terbuka dan klik pada elemen yang
ingin Anda gunakan, klik pada tampilan OpenGL sentral akan
menggunakan elemen yang sedang dipilih.
Setelah memilih elemen Anda dapat klik kiri pada hitam (saat ini
kosong) tampilan. Ini akan menempatkan satu atom dari elemen yang
Anda pilih di bawah kursor mouse. Jika opsi 'Sesuaikan hidrogen'
diperiksa maka sesuai dengan jumlah hidrogen akan ditambahkan ke
molekul untuk valensi normal. Menghapus cek dari kotak akan
menghentikan hal ini sedang dilakukan.
Jika Anda menemukan kesalahan atau ingin menghapus atom tertentu maka
mengklik kanan pada atom (atau obligasi) akan menghapusnya.
Perhatikan bahwa jika 'Sesuaikan hidrogen' dicentang maka Anda tidak
dapat menghapus hidrogen ditambahkan sebagai menyesuaikan hidrogen
fungsi menyesuaikan jumlah hidrogen secara otomatis sehingga menambah
hidrogen kembali dihapus.
Untuk benar-benar membangun sebuah molekul lengkap Anda mungkin akan
ingin menggambar sesuatu yang lebih kompleks. Kiri mengklik pada atom
yang ada, menjaga tombol mouse ditekan dan menyeret ke lokasi lain
akan menciptakan ikatan antara atom yang ada dan yang baru. Orde
ikatan dapat dipilih dalam 'Obligasi Orde' drop down. Atau klik pada
obligasi akan menyesuaikan pesanan mereka (single, double, triple,
tunggal).
Jika Anda perlu mengubah atom yang ada sehingga elemen lain cukup
pilih elemen yang diinginkan dan klik pada atom yang ada. Dengan
menyesuaikan hidrogen yang dapat digunakan untuk 'tumbuh' molekul
dengan mengubah hidrogen. Hal ini mungkin untuk membangun banyak
struktur menggunakan alat ini. Avogadro juga memiliki 'Fragment
Library' yang memungkinkan Anda untuk menelusuri daftar fragmen
molekul, memilih salah satu dan masukkan ke dalam molekul saat ini.
Avogadro memiliki tiga medan gaya yang tersedia yang dapat digunakan
untuk mengoptimalkan struktur molekul ditarik. Standarnya menggunakan
satu disebut MMFF94 yang dapat menangani struktur organik yang paling
umum. Jika Anda telah menggunakan logam transisi Anda mungkin ingin
menggunakan UFF yang dapat menangani setiap elemen. Cukup mengklik
'Extensions->
Optimize
Geometry
'
biasanya cukup untuk memberikan struktur yang cukup
baik dioptimalkan. Pengaturan medan kekuatan dapat diubah dengan
pergi ke
'Extensions->Molecular
Mechanics->Setup Force Field...'
Anda tidak selalu
bisa melakukannya dengan benar pertama kali sekitar, atau mungkin
optimasi geometri belum memberikan Anda geometri Anda tertarik
Avoogadro memiliki dua alat untuk membantu dengan memanipulasi
molekul yang telah ditarik. Ini adalah Obligasi Centric Memanipulasi
Alat dan Memanipulasi Tool. Mereka berdua memungkinkan Anda untuk
memanipulasi molekul yang ada.
Banyak alat dapat
bekerja di kedua atom diklik atau pilihan atom. Select Tool yang
memungkinkan Anda untuk membuat pilihan dan kemudian bekerja pada
pilihan ini menggunakan alat yang berbeda. Misalnya sekelompok lima
atom dapat dipilih menggunakan Select Tool dan kemudian atom-atom
dapat dipindahkan dengan memilih Memanipulasi Tool dan meninggalkan
mengklik seleksi sambil menggerakkan mouse sampai konfigurasi yang
diinginkan diperoleh.
Avogadro mendukung
undo / redo. Semua menggambar operasi dapat dibatalkan dan diulang
dengan menggunakan item menu yang sesuai dalam menu edit. Jika Anda
pernah membuat kesalahan cukup pilih 'Edit-> Undo' (atau Ctrl +
Z). Setelah Anda puas dengan molekul yang telah diambil Anda dapat
menyimpannya dengan menggunakan 'File-> Save As ...' item menu.
Sebuah array besar format file yang ditawarkan. Jika tidak ada
perpanjangan diberikan Avogadro akan langsung menggunakan CML yang
merupakan standar yang baik jika Anda tidak yakin format apa yang
dipakai.
Langganan:
Komentar (Atom)